-
Hva er Fampyra® -
Dosering -
FAQ -
Sikkerhetsinformasjon -
Klinisk effekt
Effekt på gangfunksjon
Fampyra® (fampridin) ga vedvarende forbedring av ganghastigheten hos signifikant flere pasienter sammenlignet med placebo i to placebo kontrollerte kliniske studier, p<0,001(MS-F203 og MS-F204)1-3
Økt ganghastighet hos responderende pasienter kunne påvises allerede to uker etter påbegynt behandling med Fampyra® (fampridin)2-3
Fampyra® (fampridin) var godt tolerert av pasienter med MS i forlengelsesstudier av studiene MS-F203 og MS-F204 – med oral administrasjon av Fampyra® (fampridin) i opp til 5 år – ingen nye sikkerhetsdata ble observert6
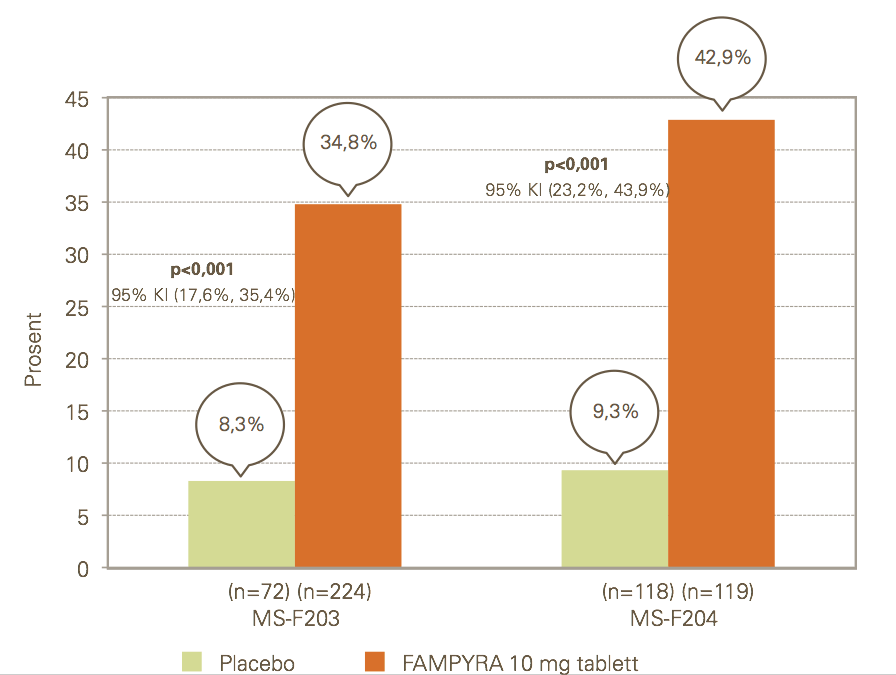
Det er utført tre randomiserte, dobbeltblinde, placebokontrollerte bekreftende fase III-studier (MSF203, MS-F204 og 218MS305).
Andelen av respondere var uavhengig av samtidig immunmodulerende behandling (inkludert interferoner, glatirameracetat, fingolimod og natalizumab). Fampyra-dosen var 10 mg to ganger daglig.
Referanser:
- Fampyra preparatomtale (SPC) 11/2019, avsnitt 5.1
- Goodman A, Brown T, Krupp L et al. Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. Lancet 2009;373:732-738.
- Goodman A, Brown T, Edwards K et al. A phase 3 trial of extended release oral dalfampridine in multiple sclerosis. Ann Neurol 2010;68:494-502.
- Goodman A, Bethoux F, Brown T, Schapiro R et al, Long-term safety and efficacy of dalfampridine for walking impairment in patients with multiple sclerosis: Results of open-label extensions of two Phase 3 clinical trials, Multiple Sclerosis Journal 1– 10, 2015
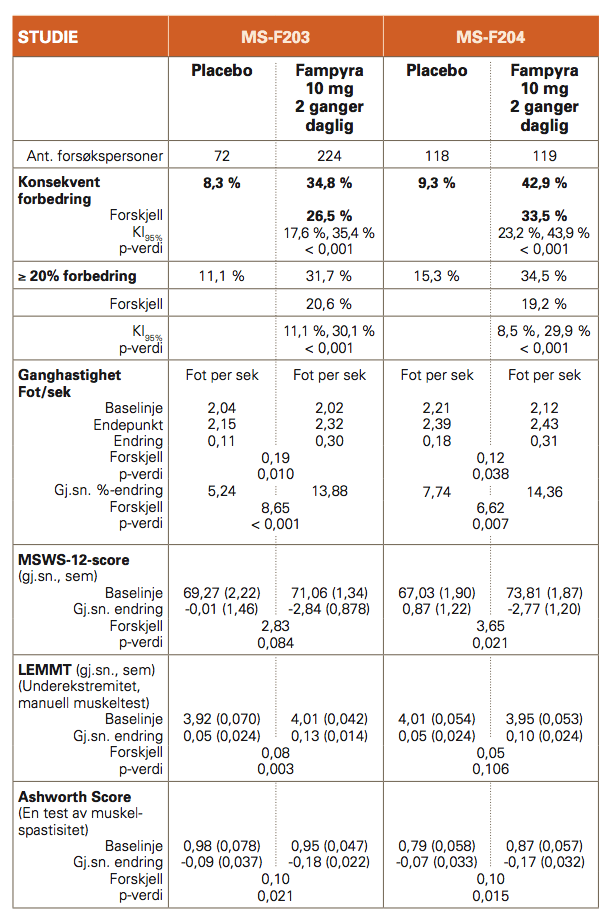
Det primære endepunktet i studie MS-F203 og MS-F204 var responsraten for ganghastighet målt ved bruk av Timed 25-foot Walk (T25FW). En responder ble definert som en pasient som konsekvent hadde en raskere ganghastighet ved minst tre konsultasjoner av fire mulige i løpet av den dobbeltblinde perioden sammenlignet med høyeste verdi blant fem konsultasjoner uten behandling.
Det var en signifikant høyere andel respondere blant pasientene som fikk behandling med Fampyra enn blant dem som fikk placebo (MS-F203: 34,8 % mot 8,3 %, p<0,001; MS-F204: 42,9 % mot 9,3 %, p<0,001).
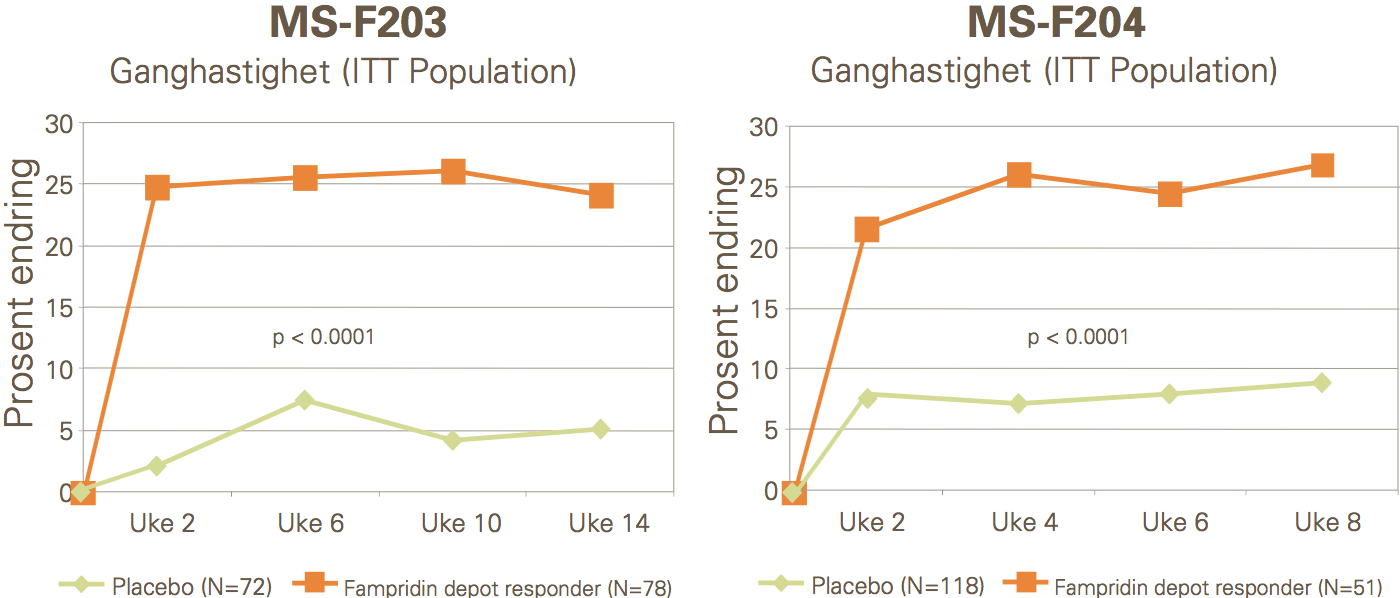
Pasienter som responderte på Fampyra, økte sin ganghastighet med gjennomsnittlig 26,3 % mot 5,3 % for placebo (p<0,001) (MS-F203) og 25,3 % mot 7,8 % (p<0,001) (MS-F204). Forbedringen viste seg raskt (i løpet av uker) etter oppstart med Fampyra.
Statistisk og klinisk betydningsfulle forbedringer i gangfunksjonen ble observert, målt ved bruk av 12- item Multiple Sclerosis Walking Scale.
ENHANCE-studien (studie 218MS305) ble gjennomført med 636 forsøkspersoner med multippel sklerose og gangproblemer. Varigheten av dobbeltblind behandling var 24 uker med en 2 ukers oppfølging etter 9 behandling.
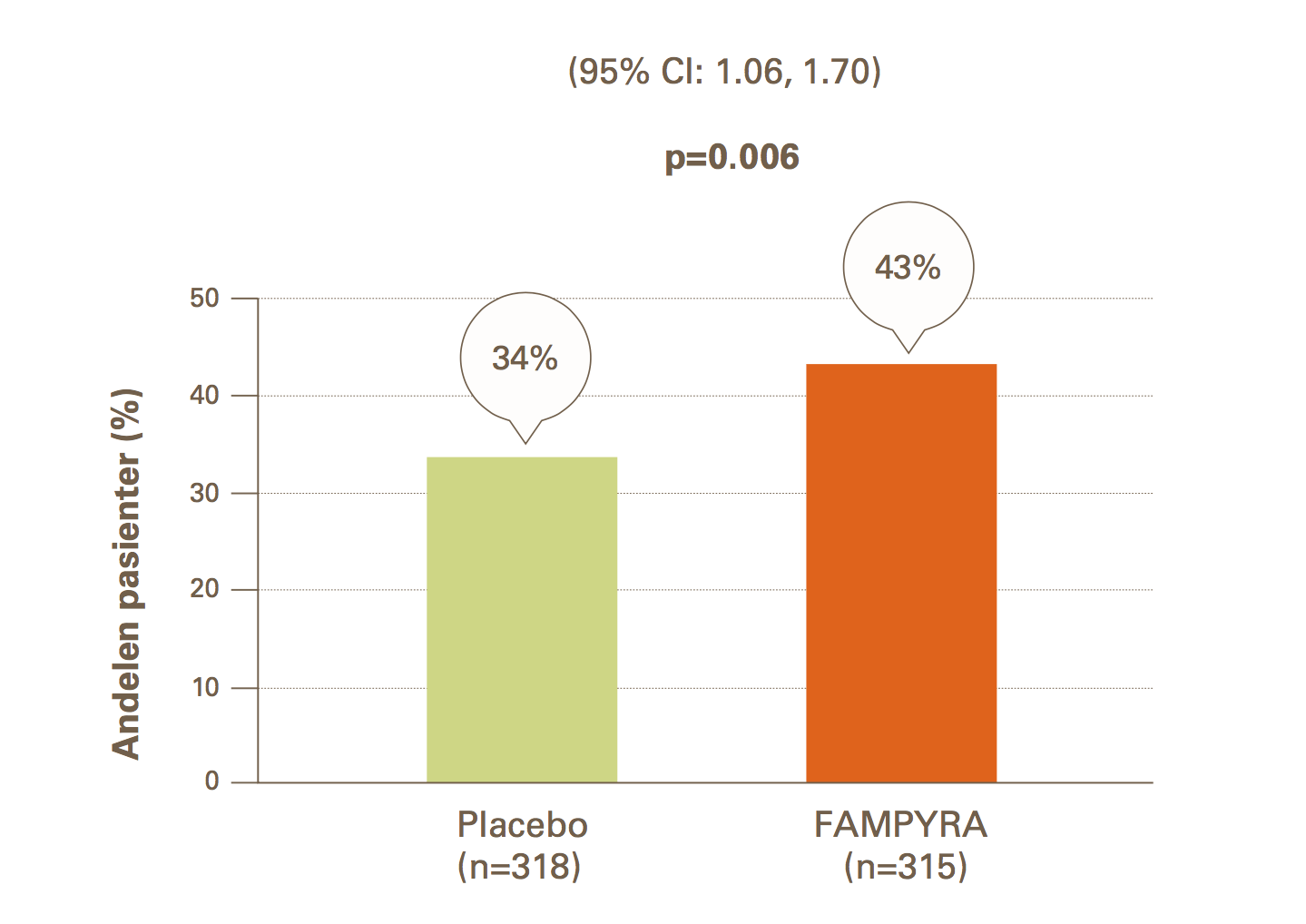
Det primære endepunktet var forbedring av gangevne, målt som andelen av pasienter som oppnådde en gjennomsnittlig forbedring i MSWS-12-score på ≥ 8 poeng fra baseline i 24 uker. I denne studien var det en statistisk signifikant behandlingsforskjell, der en større andel av Fampyrabehandlede pasienter hadde en forbedring i gangevne, sammenlignet med pasienter som fikk placebo (relativ risiko på 1,38 (95 % KI: (1,06, 1,70)).
Forbedring oppsto vanligvis innen 2 til 4 uker etter behandlingsstart, og opphørte innen 2 uker etter seponering av behandlingen. Pasienter som fikk behandling med Fampyra hadde også en statistisk signifikant forbedring i Timed Up and Go (TUG)-test, et mål for statisk og dynamisk balanse og fysisk mobilitet. For dette sekundære endepunktet oppnådde en større andel av Fampyra-behandlede pasienter ≥ 15 % gjennomsnittlig forbedring fra TUG-hastighet ved baseline i en 24 ukers periode, sammenlignet med placebo. Forskjellen i Berg Balance Scale (BBS, et mål for statisk balanse) var ikke statistisk signifikant.
I tillegg viste pasienter behandlet med Fampyra en statistisk signifikant gjennomsnittlig forbedring i fysisk score på Multiple Sclerosis Impact Scale (MSIS-29) fra baseline sammenlignet placebo (LSM forskjell -3,31, p<0,001).
Statistisk og klinisk betydningsfulle forbedringer i gangfunksjonen,målt ved MSWS -12 ved uke 24
*intention to treat populasjonen = 63
Tabell 2: Studie 218MS305
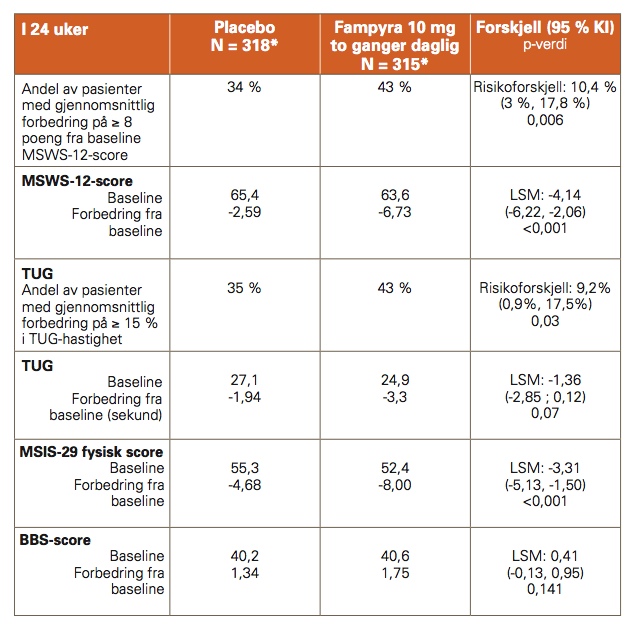
* Intent to treat-populasjon = 633. LSM = Least square mean (gjennomsnitt beregnet ved bruk av minste kvadraters metode)
Det europeiske legemiddelkontoret (The European Medicines Agency) har gitt unntak fra forpliktelsen til å presentere resultater fra studier med Fampyra i alle undergrupper av den pediatriske populasjonen ved behandling av multippel sklerose med gangproblemer.
Referanse: Fampyra preparatomtale (SPC) 11/2019, avsnitt 5.1.
