Advarsler i forhold til bruk av MS-legemiddelet Tysabri
Progressiv multifokal leukoencefalopati (PML)
Bruk av TYSABRI har vært forbundet med en økt risiko for PML, en opportunistisk infeksjon forårsaket av JC-virus, som kan være dødelig eller føre til alvorlig funksjonsnedsettelse. På grunn av denne økte risikoen for å utvikle PML, bør fordelene og risikoen ved TYSABRI-behandling revurderes individuelt av legespesialisten og pasienten. Pasienter må overvåkes regelmessig gjennom behandlingen og skal informeres, sammen med sine omsorgspersoner, om tidlige tegn og symptomer på PML. JC-virus forårsaker også granulacellenevronopati (GCN), som er rapportert hos pasienter som har fått behandling med TYSABRI. Symptomer på JCV-GCN ligner symptomer på PML (dvs. cerebellart syndrom).
Følgende risikofaktorer er forbundet med økt risiko for PML:
Forekomst av anti-JCV-antistoffer.
Behandlingsvarighet, særlig utover 2 år. Etter 2 år skal alle pasienter informeres på nytt om risikoen for PML ved bruk av TYSABRI.
Bruk av immunsuppressiver før behandling med TYSABRI.
Pasienter som er positive for anti-JCV-antistoffer har økt risiko for å utvikle PML, sammenlignet med pasienter som er negative for anti-JCV-antistoffer. Pasienter som har alle tre risikofaktorene for PML (dvs. de er positive for anti-JCV-antistoffer og har fått behandling med TYSABRI i mer enn 2 år og har tidligere fått immunsuppressiv behandling) har betydelig høyere risiko for PML.
Hos anti-JCV-antistoffpositive pasienter som får behandling med TYSABRI og som ikke tidligere har fått behandling med immunsuppressiver, har nivået av anti-JCV-antistoffrespons (-indeks) sammenheng med risikonivået for PML.
Hos pasienter som anses å ha høy risiko skal behandling med TYSABRI kun fortsette hvis nytten er større enn risikoen. Se ”Informasjon til legen og retningslinjer for håndtering” for beregning av risiko for PML i de ulike undergruppene av pasienter.
I en forhåndsspesifisert, retrospektiv analyse av amerikanske anti-JCV-antistoffpositive TYSABRI-pasienter (TOUCH-registeret) ble risikoen for PML sammenlignet for pasienter som ble behandlet med godkjent doseringsintervall og pasienter behandlet med forlenget doseringsintervall (gjennomsnittlig doseringsintervall på ca. 6 uker), de siste 18 månedene av behandlingen. De fleste (85 %) pasientene som ble behandlet med forlenget doseringsintervall hadde fått den godkjente doseringen i ≥ 1 år før de byttet til forlenget doseringsintervall. Interimanalysen viste en lavere risiko for PML hos pasienter behandlet med forlenget doseringsintervall (hasardratio = 0,06, 95 % KI for hasardratio = 0,01‑0,22). Effekten av TYSABRI ved administrering med forlenget doseringsintervall er ikke fastslått, og nytte/risiko-forholdet ved bruk av forlenget doseringsintervall er derfor ikke kjent (se pkt. 4.4).
Effekt er modellert for pasienter som bytter til lengre doseringsintervall etter ≥ 1 år med godkjent dosering av TYSABRI og som ikke hadde anfall i året før doseringsbytte. Statistisk modellering og simulering av farmakokinetikk/farmakodynamikk indikerer at risikoen for sykdomsaktivitet hos MS‑pasienter som bytter til lengre doseringsintervall kan være høyere hos pasienter med kroppsvekt > 80 kg eller pasienter med doseringsintervaller på ≥ 7 uker. Ingen prospektive kliniske studier er gjennomført for å validere disse funnene.
Det foreligger ikke publiserte data knyttet til effekt og sikkerhet ved forlenget doseringsintervall med Tysabri SC (subkutan).
Tysabri preparatomtale 12/2023, avsnitt 4.4.

Beregninger av PML-risiko hos anti-JCV-antistoffpositive pasienter ble utledet ved bruk av en metode som involverer dødelighetstabeller («Life Table Method»), basert på den sammenslåtte kohorten med 21 696 pasienter som deltok i de kliniske studiene STRATIFY-2, TOP, TYGRIS og STRATA. Ytterligere stratifisering av PML-risiko ved bruk av intervaller for anti-JCVantistoffindeks for pasienter som ikke tidligere har brukt immunsuppressiver, ble utledet ved å kombinere den totale årlige risikoen med antistoffindeksfordelingen. Beregninger av PML-risiko hos anti-JCV-antistoffpositive pasienter som tidligere har fått behandling med immunsuppressiver er basert på kliniske data fra bruk av TYSABRI, der tidligere bruk av immunsuppressiver omfattet behandling med følgende legemidler: mitoksantron, metotreksat, azatioprin, cyklofosfamid og mykofenolatmofetil. Risikoen for PML hos anti-JCV-antistoffnegative pasienter ble beregnet ut fra data etter markedsføring fra ca. 125 000 TYSABRI-eksponerte pasienter.
Referanse: Adaptert fra Informasjon til legen og retningslinjer for håndtering av pasienter med multippel sklerose som behandles med TYSABRI, versjon 19 02/2021
Testing for anti-JCV-antistoffer gir understøttende informasjon for klassifisering av risikoen ved TYSABRI-behandling. Testing for anti-JCV-antistoffer i serum anbefales før behandling med TYSABRI initieres og hos pasienter som får legemidlet og har ukjent antistoffstatus. Anti-JCV-antistoffnegative pasienter kan likevel ha risiko for PML, f.eks. på grunn av ny JCV-infeksjon, svingninger i antistoffstatus eller et falskt negativt testresultat. Det anbefales at anti-JCV-antistoffnegative pasienter testes på nytt hver 6. måned. Det anbefales at pasienter med lav indeks som ikke tidligere har fått behandling med immunsuppressiver testes på nytt hver 6. måned fra og med det tidspunktet de har fått behandling i 2 år.
Tester for anti-JCV-antistoffer (ELISA) skal ikke brukes for å diagnostisere PML. Bruk av plasmaferese eller intravenøst immunglobulin (IVIg) kan påvirke tolkningen av tester for anti-JCV-antistoffer i serum. Pasienter skal ikke testes for anti-JCV-antistoffer de 2 første ukene etter plasmaferese fordi antistoffer har blitt fjernet fra serum, eller de 6 første månedene etter bruk av IVIg (dvs. 6 måneder = 5x halveringstiden for immunglobuliner).
Se ”Informasjon til legen og retningslinjer for håndtering” for ytterligere informasjon om testing for anti-JCV-antistoffer.
Før behandling med TYSABRI initieres bør det foreligge en ny (vanligvis ikke eldre enn 3 måneder) MRI, som skal brukes som referanse. Denne bør gjentas minst én gang i året. Hyppigere MRI-undersøkelser (f.eks. hver 3. til 6. måned) ved bruk av en forkortet protokoll, bør vurderes for pasienter med høyere risiko for PML. Dette omfatter:
Pasienter som har alle tre risikofaktorer for PML (dvs. er anti-JCV-antistoffpositive og har fått behandling med TYSABRI i mer enn 2 år og har tidligere fått immunsuppressiv behandling).
Eller
Pasienter med en høy anti-JCV-antistoffindeks som har fått behandling med TYSABRI i mer enn 2 år og som ikke tidligere har fått immunsuppressiv behandling.
Det er ikke utført studier for å evaluere effekt og sikkerhet av TYSABRI ved bytte fra sykdomsmodifiserende behandling med immunsuppressiv effekt. Det er ikke kjent om pasienter som bytter fra slik behandling til TYSABRI har økt risiko for PML, og disse pasientene bør derfor overvåkes hyppigere (dvs. på samme måte som pasienter som bytter fra immunsuppressiver til TYSABRI).
Gjeldende data tyder på at risikoen for PML er lav ved en indeks på 0,9 eller lavere, og øker betydelig ved en indeks på over 1,5 hos pasienter som har fått behandling med TYSABRI i mer enn 2 år (se ”Informasjon til legen og retningslinjer for håndtering” for ytterligere informasjon).
PML skal vurderes som en differensialdiagnose hos alle MS-pasienter som får TYSABRI og som utvikler nevrologiske symptomer og/eller nye hjernelesjoner sett på MRI. Tilfeller av asymptomatisk PML basert på MRI og positiv JCV-DNA i cerebrospinalvæsken, er rapportert.
Leger henvises til ”Informasjon til legen og retningslinjer for håndtering” for ytterligere informasjon om håndtering av risikoen for PML hos pasienter som får behandling med TYSABRI.
Anbefalt oppfølging av pasienten
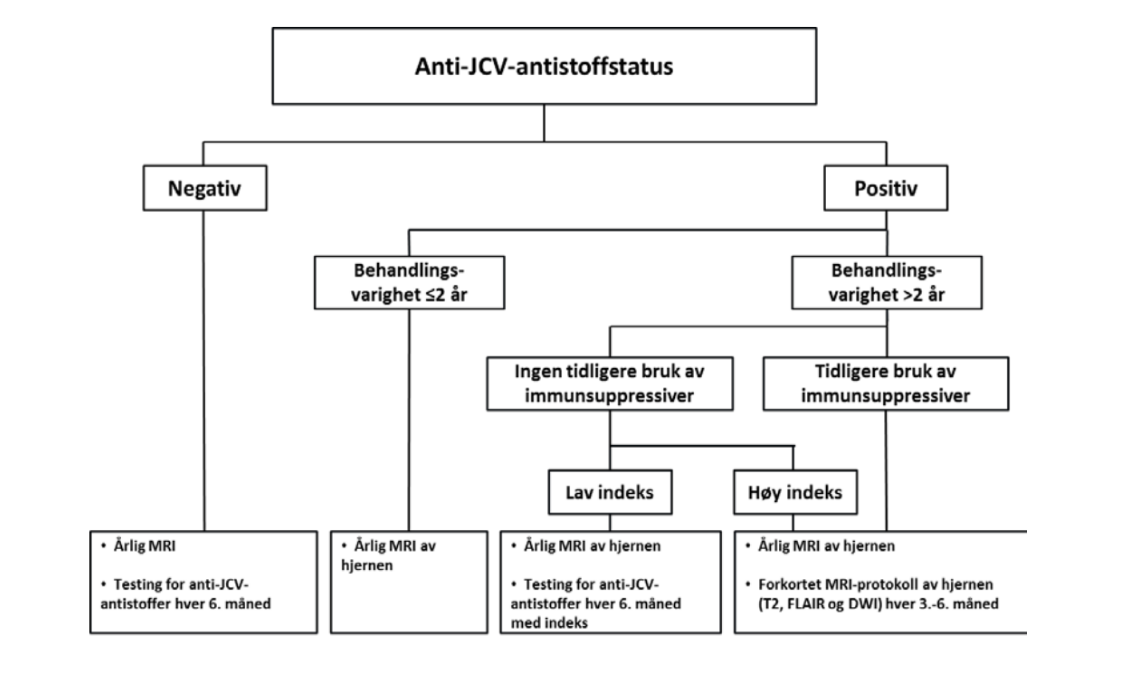
Adaptert fra Informasjon til legen og retningslinjer for håndtering av pasienter med multippel sklerose som behandles med TYSABRI, versjon 19 02/2021
Dersom det er mistanke om PML eller JCV-GCN, må videre dosering utsettes til PML er utelukket. Legen bør evaluere pasienten for å avgjøre om symptomene er tegn på nevrologisk dysfunksjon og, hvis dette er tilfelle, hvorvidt disse symptomene er typiske for MS eller er forenlig med PML eller JCV-GCN. Hvis det er tvil, bør det gjøres en ytterligere evaluering, inkludert MRI-skanning, fortrinnsvis med kontrast (sammenlignet med MRI ved baseline før behandling), testing av cerebrospinalvæske for JC-virus-DNA og gjentatt nevrologisk evaluering, som beskrevet i ”Informasjon til legen og retningslinjer for håndtering” (se Veiledning). Når legen har utelukket PML og/eller JCV-GCN (om nødvendig ved gjentatt klinisk undersøkelse, bildedannende diagnostikk og/eller laboratorieundersøkelser hvis det fortsatt er klinisk mistanke), kan doseringen med TYSABRI gjenopptas.
Legen bør være spesielt oppmerksom på symptomer som kan tyde på PML eller JCV-GCN og som pasienten selv kanskje ikke legger merke til (f.eks. kognitive eller psykiatriske symptomer eller cerebellart syndrom). Pasientene bør også rådes til å informere sin partner eller sine omsorgspersoner om behandlingen, fordi de kan legge merke til symptomer som pasienten selv ikke er klar over. PML er rapportert etter seponering av TYSABRI hos pasienter som ikke har funn som tyder på PML ved seponering. Pasienter og leger bør fortsette å følge samme overvåkingsprotokoll og være oppmerksom på eventuelle nye tegn eller symptomer som kan tyde på PML i ca. 6 måneder etter seponering av TYSABRI.
Hvis en pasient utvikler PML, må administrering av TYSABRI avbrytes permanent. Etter rekonstitusjon av immunsystemet hos immunkompromitterte pasienter med PML er det sett forbedring.
Basert på en retrospektiv analyse av pasienter som er behandlet med natalizumab etter godkjenning, ble det ikke observert noen forskjell på 2- års overlevelsesrate etter PML-diagnose mellom pasienter som fikk plasmautskifting, og de som ikke fikk det. For andre vurderinger omkring behandling av PML, se ”Informasjon til legen og retningslinjer for håndtering”.
IRIS oppstår hos nesten alle TYSABRI-behandlede pasienter med PML etter seponering eller fjerning av legemidlet. IRIS antas å skyldes gjenoppretting av immunfunksjonen hos pasienter med PML, noe som kan føre til alvorlige nevrologiske komplikasjoner, og som kan være dødelig. Det bør iverksettes overvåking med tanke på utvikling av IRIS og egnet behandling av assosiert inflammasjon under restitueringen etter PML (se ”Informasjon til legen og retningslinjer for håndtering” for ytterligere informasjon).
Andre opportunistiske infeksjoner er rapportert ved bruk av TYSABRI, hovedsakelig hos pasienter med Crohns sykdom som var immunkompromitterte, eller ved signifikant komorbiditet. Økt risiko for andre opportunistiske infeksjoner ved bruk av legemidlet hos pasienter uten slik komorbiditet kan imidlertid ikke utelukkes per i dag. Opportunistiske infeksjoner ble også funnet hos MS-pasienter som ble behandlet med TYSABRI som monoterapi (se punkt 4.8 i preparatomtalen).
TYSABRI øker risikoen for å utvikle encefalitt og meningitt forårsaket av herpes simplex- og varicella zoster-virus. Alvorlige, livstruende og enkelte fatale tilfeller er rapportert hos MS-pasienter som har fått TYSABRI etter markedsføring (se punkt 4.8 i preparatomtalen). Hvis herpesencefalitt eller -meningitt oppstår, skal legemidlet seponeres og egnet behandling mot herpesencefalitt eller -meningitt gis.
Akutt retinal nekrose (ARN) er en sjelden virusinfeksjon i retina forårsaket av herpesvirusfamilien (f.eks. varicella zoster). ARN kan utvikle seg svært raskt og kan potensielt føre til blindhet. ARN er observert hos pasienter som bruker TYSABRI. Pasienter med øyesymptomer som redusert skarpsyn og røde og smertefulle øyne bør henvises til undersøkelse av retina med tanke på ARN. Dersom diagnosen ARN stilles, bør seponering av TYSABRI vurderes.
Forskrivende lege bør være klar over muligheten for at andre opportunistiske infeksjoner kan oppstå under behandling med TYSABRI, og bør inkludere disse i differensialdiagnosene av infeksjoner som oppstår hos pasienter som er behandlet med TYSABRI. Hvis det foreligger mistanke om en opportunistisk infeksjon, skal doseringen med TYSABRI utsettes til slik infeksjon kan utelukkes gjennom ytterligere evaluering.
Hvis en pasient som får behandling med TYSABRI utvikler en opportunistisk infeksjon, må behandlingen med legemidlet avbrytes permanent.
Alle leger som skal forskrive TYSABRI, må forsikre seg om at de kjenner til "Informasjon til legen og retningslinjer for håndtering".
Legene må diskutere nytte og risiko av TYSABRI-behandlingen med pasienten og gi dem et pasientkort. Pasientene bør informeres om at dersom de utvikler en infeksjon bør de informere legen om at de får behandling med TYSABRI.
Legene bør informere pasientene om hvor viktig det er at de ikke avbryter doseringen, særlig i de første månedene av behandlingen (se overfølsomhet).
Overfølsomhetsreaksjoner har vært forbundet med TYSABRI, inkludert alvorlige systemiske reaksjoner. Disse reaksjonene oppstod vanligvis under infusjon eller opptil 1 time etter avsluttet infusjon. Risikoen for overfølsomhet var størst i forbindelse med de første infusjonene og hos pasienter som ble reeksponert for TYSABRI etter en innledende kort eksponering (én eller to infusjoner) og en lengre periode (tre måneder eller mer) uten behandling.Risikoen for overfølsomhetsreaksjoner bør imidlertid tas i betraktning ved alle infusjoner som administreres.
Pasientene skal observeres under infusjonen og i 1 time etter avsluttet infusjon. Ressurser til håndtering av overfølsomhetsreaksjoner bør være tilgjengelig.
Ved første symptomer eller tegn på overfølsomhet må administrasjonen av TYSABRI avbrytes og egnet behandling igangsettes. Hos pasienter som har opplevd en overfølsomhetsreaksjon, må TYSABRI-behandlingen avbrytes permanent.
Sikkerhet og effekt av TYSABRI ved bruk sammen med andre immunsuppressiver og antineoplastiske midler er ikke fullstendig fastlagt. Bruk av disse midlene samtidig med TYSABRI kan øke risikoen for infeksjoner, inkludert opportunistiske infeksjoner, og er kontraindisert.
I kliniske fase III-studier med MS-pasienter ble samtidig behandling av anfall med en kort kur med kortikosteroider ikke forbundet med økt infeksjonshyppighet. Korte kurer med kortikosteroider kan brukes i kombinasjon med TYSABRI.
Pasienter som tidligere har vært behandlet med immunsuppressiver har økt risiko for å utvikle PML.
Det er ikke utført studier for å evaluere effekt og sikkerhet av TYSABRI ved bytte fra sykdomsmodifiserende behandling med immunsuppressiv effekt. Det er ikke kjent om pasienter som bytter fra slik behandling til TYSABRI har økt risiko for PML, og disse pasientene bør derfor overvåkes hyppigere (dvs. på samme måte som pasienter som bytter fra immunsuppressiver til TYSABRI, se ”MRI-undersøkelse for PML”).
Forsiktighet bør utvises hos pasienter som tidligere har fått immunsuppressiver, slik at immunfunksjonen får tilstrekkelig tid til å gjenopprettes. Legen må evaluere hvert enkelt tilfelle for å avgjøre om det er tegn på en immunkompromittert tilstand før behandlingen med TYSABRI påbegynnes.
Når pasienter bytter fra en annen sykdomsmodifiserende behandling til TYSABRI, må halveringstiden og virkningsmekanismen til den foregående behandlingen tas med i vurderingen for å unngå en additiv immuneffekt og samtidig minimere risikoen for reaktivering av sykdommen. Full blodcelletelling (inkludert lymfocytter) anbefales før oppstart av behandling med TYSABRI for å sikre at immuneffektene av den foregående behandlingen (dvs. cytopeni) er opphørt.
Pasienter kan bytte direkte fra beta-interferon eller glatirameracetat til TYSABRI, forutsatt at det ikke foreligger relevante behandlingsrelaterte unormale funn, f.eks. nøytropeni eller lymfopeni.
Ved bytte fra dimetylfumarat bør utvaskingsperioden være tilstrekkelig lang til at lymfocyttallet er gjenopprettet før oppstart av behandling med TYSABRI.
Etter seponering av fingolimod vil lymfocyttallet gradvis komme tilbake til normalområdet innen 1‑2 måneder etter avsluttet behandling. Utvaskingsperioden bør være tilstrekkelig lang til at lymfocyttallet er gjenopprettet før oppstart av behandling med TYSABRI.
Teriflunomid elimineres sakte fra plasma. Uten en prosedyre for akselerert eliminasjon kan clearance av teriflunomid fra plasma ta fra flere måneder opptil 2 år. En akselerert eliminasjonsprosedyre, som beskrevet i preparatomtalen for teriflunomid, anbefales, alternativt bør en utvaskingsperiode ikke være kortere enn 3,5 måneder. Forsiktighet vedrørende samtidige immuneffekter er nødvendig når pasienter bytter fra teriflunomid til TYSABRI.
Alemtuzumab har betydelige, langvarige immunsuppressive effekter. Den faktiske varigheten av disse effektene er ikke kjent, og oppstart av behandling med TYSABRI etter alemtuzumab anbefales ikke med mindre nytten klart oppveier risikoen for den enkelte pasient.
Sykdomsforverring eller infusjonsrelaterte hendelser kan tyde på utvikling av antistoffer mot natalizumab. I slike tilfeller bør tilstedeværelse av antistoffer undersøkes. Dersom pasienten fortsatt er positiv for antistoffer i en bekreftende test etter minst seks uker, bør behandlingen avbrytes, fordi persisterende antistoffer er forbundet med en vesentlig reduksjon i effekten av TYSABRI og en økt forekomst av overfølsomhetsreaksjoner.
Pasienter som har fått en innledende, kort eksponering for TYSABRI og deretter har hatt en lengre periode uten behandling, har høyere risiko for å utvikle anti-natalizumab-antistoffer og/eller overfølsomhet ved gjenopptak av doseringen, og tilstedeværelse av antistoffer bør derfor undersøkes. Dersom resultatet fortsatt er positivt i en bekreftende test etter minst seks uker, bør pasienten ikke få videre behandling med TYSABRI.
Etter markedsføring er det rapportert spontane, alvorlige bivirkninger i form av leverskader. Disse leverskadene kan forekomme når som helst under behandlingen, også allerede etter den første dosen. I noen tilfeller oppsto bivirkningen på nytt etter at behandlingen med TYSABRI ble gjenopptatt. Noen pasienter som tidligere har hatt unormale leverprøver har opplevd en forverring av unormale leverprøver under behandling med TYSABRI. Pasientene bør overvåkes på egnet måte for svekket leverfunksjon, og må informeres om at de skal kontakte legen hvis det oppstår tegn og symptomer som gir mistanke om leverskade, f.eks. gulsott og oppkast. I tilfeller med betydelig leverskade bør behandlingen med TYSABRI avbrytes.
Dersom det er bestemt at behandlingen med natalizumab skal avbrytes, må legen være klar over at natalizumab fortsatt er i blodet og har farmakodynamiske effekter (f.eks. økt lymfocyttall) i ca. 12 uker etter siste dose. Hvis annen behandling startes i løpet av denne perioden, vil dette resultere i samtidig eksponering for natalizumab. For legemidler som interferon og glatirameracetat ble samtidig eksponering av slik varighet ikke forbundet med noen sikkerhetsrisiko i kliniske studier. Det finnes ingen data fra MS-pasienter vedrørende samtidig eksponering for immunsuppressiver. Bruk av disse legemidlene kort tid etter seponering av natalizumab kan føre til en immunsuppressiv tilleggseffekt. Dette bør overveies nøye fra tilfelle til tilfelle, og en utvaskingsperiode for natalizumab kan være aktuelt. Korte steroidkurer for å behandle anfall var ikke forbundet med økt forekomst av infeksjoner i kliniske studier.
Dette legemidlet inneholder mindre enn 1 mmol natrium (23 mg) per dose (300 mg natalizumab), og er så godt som “natriumfritt”.
Tysabri preparatomtale 12.2023, avsnitt 4.4.
