Bivirkninger ved bruk av MS-legemiddelet Tysabri
Som alle legemidler kan dette legemidlet forårsake bivirkninger, men ikke alle får det. Pasienten bør kontakte lege eller sykepleier umiddelbart hvis hun/han legger merke til noe av følgende:
Symptomer på alvorlig infeksjon, som kan være:
Feber av ukjent årsak
Kraftig diaré
Kortpustethet
Langvarig svimmelhet
Hodepine
Vekttap
Likegyldighet
Svekket syn
Smertefulle eller røde øyne
En gruppe symptomer forårsaket av en alvorlig infeksjon i hjernen. Dette kan være:
Endringer i personlighet og atferd, som forvirring, delirium eller tap av bevissthet, kramper (anfall), hodepine, kvalme/oppkast, stiv nakke, ekstrem følsomhet for sterkt lys, feber, utslett (hvor som helst på kroppen). Disse symptomene kan være forårsaket av en infeksjon i hjernen(encefalitt)eller i hjernehinnen (meningitt).
Tegn på allergi mot TYSABRI, under eller kort tid etter infusjonen:
Kløende utslett (elveblest)
Hevelser i ansikt, lepper eller tunge
Pustebesvær
Smerter eller ubehag i brystet
Økning eller senkning av blodtrykket ditt (legen eller sykepleieren oppdager dette hvis de måler blodtrykket ditt).
Tegn på mulige leverproblemer:
Huden eller det hvite i øynene blir gulfarget
Urinen blir uvanlig mørk.
TYSABRI kan også gi andre bivirkninger.
Bivirkningene er oppført nedenfor etter hvor hyppig de er rapportert i kliniske studier:
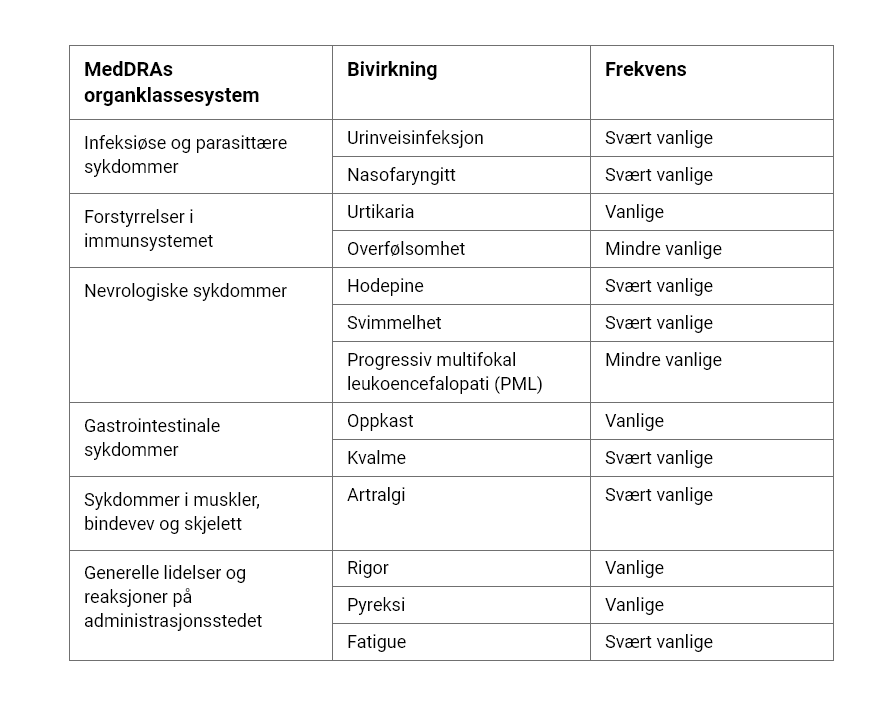
Svært vanlige bivirkninger som kan oppstå hos opptil 1 av 10 personer:
Urinveisinfeksjon
Sår hals og rennende eller tett nese
Skjelving
Kløende utslett (elveblest)
Hodepine
Svimmelhet
Kvalme
Oppkast
Leddsmerter
Feber
Utmattelse (fatigue)
Mindre vanlige bivirkninger som kan oppstå hos opptil 1 av 100 personer:
Alvorlig allergi (overfølsomhet)
Progressiv multifokal leukoencefalopati (PML)
Sjeldne bivirkninger som kan oppstå hos opptil 1 av 1000 personer:
Uvanlige infeksjoner (såkalte ”opportunistiske infeksjoner”)
Alvorlig anemi (nedsatt antall røde blodceller, som kan gjøre at huden din blir blek og at du blir kortpustet eller føler at du mangler energi)
Pasienten bør kontakte lege så snart som mulig dersom hun/han tror hun/han har en infeksjon. Pasienten bør vise pasientkortet og pakningsvedlegget til alle leger som behandler henne/han, ikke bare til nevrologen sin. Informasjon om dette finnes også i pasientkortet som pasienten har fått av legen sin.
Melding av bivirkninger
Dersom pasienten opplever bivirkninger, inkludert mulige bivirkninger som ikke er nevnt i dette pakningsvedlegget, bør lege kontaktes. Pasientene kan også melde fra om bivirkninger direkte via meldeskjema som finnes på nettsiden til Statens legemiddelverk. Ved å melde fra om bivirkninger bidrar man med informasjon om sikkerheten ved bruk av dette legemidlet.
I placebokontrollerte studier med 1617 MS-pasienter som ble behandlet med natalizumab i opptil 2 år (placebo: 1135), oppsto bivirkninger som førte til seponering av behandlingen hos 5,8 % av pasientene som ble behandlet med natalizumab (placebo: 4,8 %). I løpet av studieperioden på 2 år ble det rapportert bivirkninger hos 43,5 % av pasientene som ble behandlet med natalizumab (placebo: 39,6 %).
Bivirkningene som ble rapportert med høyest forekomst i placebokontrollerte studier med pasienter med multippel sklerose som fikk anbefalt dose av natalizumab, var svimmelhet, kvalme, urtikaria og stivhet forbundet med infusjon.
Bivirkninger som ble rapportert for natalizumab med en forekomst på 0,5 % høyere enn det som ble rapportert for placebo, er vist nedenfor. Reaksjoner er rapportert som foretrukne termer i henhold til MedDRAs konvensjoner og klassifisering av organsystem. Frekvensen ble definert som følger:
Vanlige (≥ 1/100 til < 1/10), mindre vanlige (≥ 1/1000 til < 1/100). Innenfor hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad.
Beskrivelse av utvalgte bivirkninger
I kontrollerte kliniske utprøvinger over 2 år med MS-pasienter, ble et infusjonsrelatert tilfelle definert som en bivirkning som oppsto under infusjon eller innen 1 time etter avsluttet infusjon. Disse oppsto hos 23,1 % av MS-pasientene som ble behandlet med natalizumab (placebo: 18,7 %). Bivirkninger som ble rapportert hyppigere for natalizumab enn for placebo omfattet svimmelhet, kvalme, urtikaria og rigor.
I kontrollerte kliniske utprøvinger over 2 år med MS-pasienter, oppsto overfølsomhetsreaksjoner hos opptil 4 % av pasientene. Anafylaktiske/anafylaktoide reaksjoner oppsto hos mindre enn 1 % av pasientene som fikk TYSABRI. Overfølsomhetsreaksjoner oppsto vanligvis i løpet av infusjonen eller innen én time etter avsluttet infusjon. Etter markedsføring er det rapportert overfølsomhetsreaksjoner som har oppstått med ett eller flere av følgende symptomer: hypotensjon, hypertensjon, brystsmerter, ubehag i brystet, dyspné, angioødem, i tillegg til mer vanlige symptomer, som utslett og urtikaria.
Antistoffer mot natalizumab ble funnet hos 10 % av pasientene i 2-årige kontrollerte kliniske studier med MS-pasienter. Persisterende anti-natalizumab antistoffer (én positiv test som var reproduserbar ved retesting minst 6 uker senere) ble utviklet hos ca. 6 % av pasientene. Antistoffer ble påvist ved bare ett tilfelle hos ytterligere 4 % av pasientene. Persisterende antistoffer ble forbundet med en betydelig reduksjon i effekten av TYSABRI og en økt forekomst av overfølsomhetsreaksjoner. Ytterligere infusjonsrelaterte reaksjoner forbundet med persisterende antistoffer omfattet rigor, kvalme, oppkast og rødme.
Hvis det etter ca. 6 måneders behandling foreligger mistanke om persisterende antistoffer, enten pga. redusert effekt eller pga. infusjonsrelaterte hendelser, kan dette påvises og bekreftes med en ny test 6 uker etter den første positive testen. Gitt at effekten kan reduseres eller forekomsten av overfølsomhetsreaksjoner eller infusjonsrelaterte reaksjoner kan øke hos en pasient med persisterende antistoffer, bør behandlingen avbrytes hos pasienter som utvikler persisterende antistoffer.
I kontrollerte kliniske utprøvinger over 2 år med MS-pasienter, var infeksjonsfrekvensen ca. 1,5 per pasient-år både hos pasienter som ble behandlet med natalizumab og placebo. Infeksjonene var vanligvis av lignende type hos pasientene i begge behandlingsgruppene. Ett tilfelle av cryptosporidium-diaré ble rapportert i kliniske MS-studier. I andre kliniske studier ble det rapportert tilfeller av ytterligere opportunistiske infeksjoner, noen med dødelig utfall. De fleste pasientene avbrøt ikke natalizumabbehandlingen ved infeksjoner og ble restituert etter egnet behandling.
I kliniske studier forekom herpesinfeksjoner (varicella zoster-virus, herpes simplex-virus) litt hyppigere hos pasienter som ble behandlet med natalizumab enn hos pasienter som fikk placebo. Etter markedsføring er det rapportert alvorlige, livstruende og enkelte fatale tilfeller av encefalitt og meningitt forårsaket av herpes simplex eller varicella zoster hos pasienter med multippel sklerose som får TYSABRI. Varigheten av behandlingen med TYSABRI før utbruddet varierte fra noen måneder til flere år.
Rapportering av bivirkninger etter markedsføring viser at sjeldne tilfeller av akutt retinal nekrose (ARN) er observert hos pasienter som bruker TYSABRI. Enkelte tilfeller har oppstått hos pasienter med herpesinfeksjon (f.eks. herpesmeningitt eller -encefalitt) i sentralnervesystemet (CNS). Alvorlige tilfeller av ARN, som berører enten ett eller begge øyne, har ført til blindhet hos noen pasienter. I disse tilfellene ble pasientene behandlet med antiviralia og i noen tilfeller operasjon.
Det er rapportert tilfeller av PML i kliniske utprøvinger, observasjonsstudier etter markedsføring og passiv overvåking etter markedsføring. PML fører vanligvis til alvorlig uførhet eller død. Tilfeller av JCV-GCN er også rapportert ved bruk av TYSABRI etter markedsføring. Symptomer på JCV-GCN ligner symptomer på PML.
Etter markedsføring er det rapportert spontane tilfeller av alvorlig leverskade, økning i leverenzymer og hyperbilirubinemi.
Sjeldne, alvorlige tilfeller av anemi og hemolytisk anemi er rapportert hos pasienter som ble behandlet med TYSABRI i observasjonsstudier etter markedsføring.
I løpet av behandlingsperioden på to år ble det ikke observert noen forskjeller i hyppigheten eller typen av malignitet mellom pasienter som ble behandlet med natalizumab og de som fikk placebo. Observasjon over lengre behandlingsperioder er imidlertid nødvendig før eventuell effekt av natalizumab på utvikling av malignitet kan utelukkes.
I kontrollerte kliniske studier over 2 år med MS-pasienter, var behandling med TYSABRI forbundet med økning i sirkulerende lymfocytter, monocytter, eosinofile, basofile og kjerneholdige røde blodceller. Det ble ikke sett forhøyede verdier av nøytrofile. Økningen fra baseline for lymfocytter, monocytter, eosinofile og basofile var i området 35-140 % for de enkelte celletypene, men gjennomsnittlig celletall holdt seg innenfor normalområdet. Under behandlingen med TYSABRI ble det observert mindre reduksjoner i hemoglobin (gjennomsnittlig reduksjon 0,6 g/dl), hematokrit (gjennomsnittlig reduksjon 2 %) og antall røde blodceller (gjennomsnittlig reduksjon 0,1 x 106 /liter). Alle endringer i hematologiske parametre gikk tilbake til verdiene før behandling, vanligvis innen 16 uker etter siste dose av legemidlet, og endringene var ikke forbundet med kliniske symptomer. Etter markedsføring har det også vært rapportert eosinofili (eosinofi ltall >1,5 x 109 /liter) uten kliniske symptomer. I tilfellene der TYSABRI-behandlingen ble seponert, gikk de forhøyede eosinofilnivåene tilbake til opprinnelig nivå.
Alvorlige bivirkninger ble evaluert hos 621 pediatriske MS-pasienter som var inkludert i en metaanalyse (se også pkt. 5.1). Gitt begrensningene til disse dataene, ble det ikke funnet nye bivirkningssignaler i denne pasientpopulasjonen. Ett tilfelle av herpesmeningitt ble rapportert i metaanalysen. Ingen tilfeller av PML ble funnet i metaanalysen, men PML er rapportert etter markedsføring hos pediatriske pasienter som er behandlet med natalizumab.
Melding av mistenkte bivirkninger etter godkjenning av legemidlet er viktig. Det gjør det mulig å overvåke forholdet mellom nytte og risiko for legemidlet kontinuerlig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette gjøres via meldeskjema som finnes på nettsiden til Statens legemiddelverk
Det er ingen rapporterte tilfeller av overdosering.
Referanse: Tysabri preparatomtale 12/2023 avsnitt 4.8, 4.9 og pakningsvedlegg
1. Tysabri preparatomtale 12/2023 avsnitt 4.8, 4.9 og pakningsvedlegg.
